细菌类原核生物酵母单/双杂文库构建
一. 相关应用
现如今,传统的酵母单/双杂文库试剂盒构建方法是针对真核生物的,因为真核生物的mRNA具有polyA结构,细菌类原核生物由于没有polyA结构,所以使用传统的方法无法构建出细菌类原核生物酵母单/双杂交文库。我们针对细菌类原核生物,研发出一类专门的原核生物文库构建方法,能够稳定、快速、高效的构建出高质量原核样本酵母单/双杂交文库。
酵母双杂交(yeast two hybrid) 技术是利用酵母遗传学方法分析蛋白质之间的相互作用,已被广泛应用于蛋白质组学、细胞信号转导和功能基因组学等领域,已成为分子生物学研究领域的重要实验手段。该方法建立以来,经过不断的完善和发展,不但可以检测已知蛋白质之间的相互作用,更重要的在于发现与已知蛋白相互作用的未知蛋白。目前已知的蛋白质相互作用至少有一半是通过酵母双杂交实验发现的。 而文库筛选结果直接由文库质量的好坏所决定,构建出高质量的文库是得到好的筛选结果的关键因素。
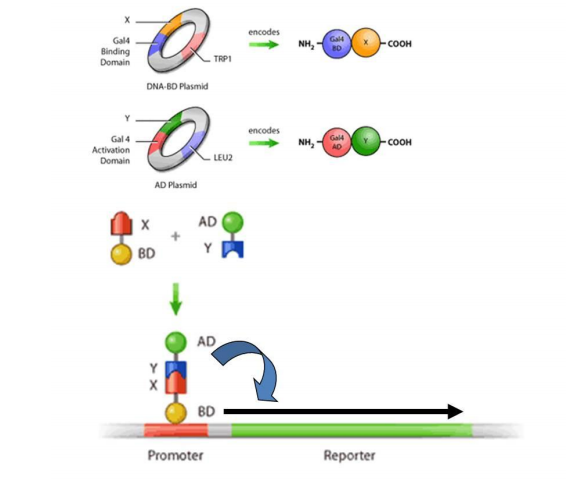
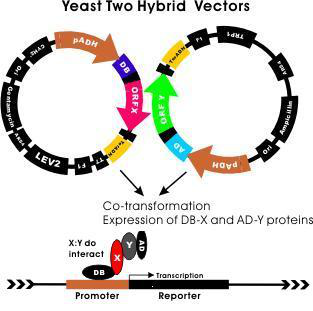
二. 酵母双杂交体系
目前酵母双杂交文库构建体系有两套:
一是Invitrogen体系,采用Gateway位点特异性重组技术(Invitrogen专利)构建文库 。
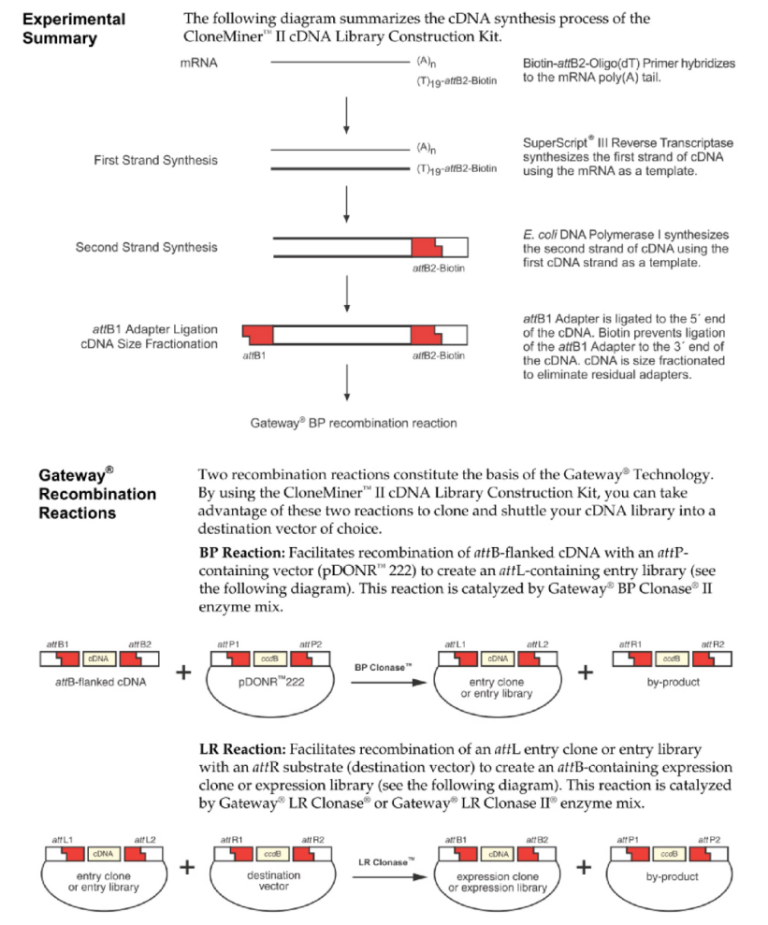
Invitrogen 体系
二是Clontech体系,酵母双杂交文库构建流程 (Clontech专利)
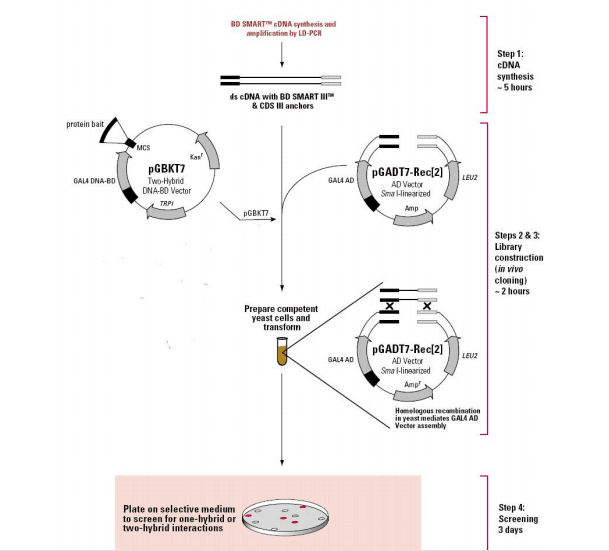
Clonetech 体系
三. 两种体系对比:
|
Clontech体系 |
Invitrogen 体系 |
|
|
Total RNA起始量 |
1-2ug |
350-500ug |
|
RNA起始量较少,只需要较少的材料即可进行。 |
RNA起始量增大,包含物种转录本信息更全面 |
|
|
mRNA分离 |
无需mRNA分离 |
Invitrogen专利试剂盒进行mRNA的分离 |
|
减少实验中间环节 |
增加mRNA的分离步骤,去除RNA内非特异模板干扰,大大提高后续反转录实验效率。 |
|
|
cDNA合成 |
SMART 技术 |
Invitrogen专利高效试剂盒 |
|
经典技术,比较容易操作。 |
在反转录实验后期无需进行15至25循环PCR扩增步骤,直接采用一步法进行cDNA合成,大大降低基因的冗余率。 |
|
|
|
酶切连接或体内重组 |
Gateway 方法重组 |
|
结合本公司特有的技术优化后可使大片段重组率达到95%以上,转化后方便客户进行QC |
||
|
酵母转化 |
以cDNA形式转化到酵母菌株中体内重组 |
次级文库混合质粒直接转化到酵母菌株中 |
|
方便客户从前期数据结果预测转化效率,提前安排实验方案,做好实验准备工作 |
||
|
文库的使用 次数 |
20-70次 |
无限次(理论情况下) |
|
Invitrogen 体系提供初级文库质粒及次级文库菌液,质粒,后续转化酵母菌株后可以根据需求分装至少100ml以上酵母工作液,一旦后期次级文库质粒使用完毕,无需重新构建文库,直接使用初级文库质粒重组构建新的次级文库,再次重新转化酵母菌株,大大节约客户使用成本。 |
||
|
文库交付标准 |
平均插入片段:400-700bp; 库容量:1-5*10^5CFU; 空载率小于10% |
平均插入片段大于1000bp; 库容量大于5*10^6CFU; 空载率小于5% |
四. 交付结果:
|
产品名称 |
交付形式 |
交付标准 |
运输 条件 |
储存 条件 |
|
文库构建报告电子版 |
|
|||
|
酵母转化报告电子版 |
|
|||
|
初级文库质粒 |
2ml冻存管(500ul) |
>80ug |
干冰 |
-80℃ |
|
次级文库菌液 |
2ml冻存管(各>1.5ml) |
20%甘油 |
干冰 |
-80℃ |
|
次级文库质粒 |
2ml冻存管(500ul) |
>80ug |
干冰 |
-80℃ |
|
酵母工作液1 |
2ml管(100管,1ml/管) |
干冰 |
-80℃ |
|
|
酵母工作液2 |
50ml管(3管,33.3ml/管) |
干冰 |
-80℃ |
|
|
筛库实验涉及的全部菌液及质粒 |
各一管 |
干冰 |
-80℃ |
|
五.项目周期
如果您不需要进行酵母转化,我们在30个工作日内进行交付,一般公司50个工作日。
六. 酵母双杂交文库质量标准:
* 文库容量≥1*107CFU ;
* 重组率:≥95 % ;
* 插入片断平均大于1.2 kb。
七.技术特色
1. 文库既可用于酵母双杂又可用于酵母单杂,也适用于酵母三杂。
2. 作用信号是在融合基因表达后,在细胞内重建转录因子的作用而给出的,省去了纯化蛋白质的繁琐步骤。
3. 检测在活细胞内进行,可以在一定程度上代表细胞内的真实情况。
4. 检测的结果可以是基因表达产物的积累效应,因而可检测存在于蛋白质之间的微弱的或暂时的相互作用。
5. 可采用不同组织、器官、细胞类型和分化时期材料构建 cDNA 文库,从而分析细胞浆、细胞核及膜结合蛋白等多种不同亚细胞部位及功能的蛋白。
6. 可以用来比对病变组织,更快的找到突变基因或者导致变异的蛋白,找到攻克方向。
7. 可以用作大规模的蛋白筛选,在较短时间内对找到某些药物对相关组织主要的作用蛋白,对于药物的修饰和改进明确方向。
8. 可以反复使用,培养快捷,适合大规模筛选使用。
八.技术特点
1. 我们并不是简单的按照 clontech 和 invitrogen 的说明书操作,而是结合我们长期的实验摸索经验,对实验细节进行改进。
a) 对于 clontech 体系,我们能使文库在原有基础上片段更长,同时降低冗余。
b) 对于 invitrogen 体系,我们为了客户后续筛库方便,摒弃使用 invitrogen 提供的次级文库载体,而是采用 pGADT7 改造后的载体,这样一来,后期既可采用共转又可采用 mating 的手段进行筛库。我们提供的初级文库可以当做普通 cDNA文库使用。如果次级文库用完可以用初级文库再次与AD 载体重组获得次级文库。
2. 我们采取 clontech 体系已经为很多客户构建过多种物种的酵母双杂交文库,有很多客户都筛选到了很有价值的基因,在筛库方面也积累了非常丰富的经验,如果老师在筛库方面有什么疑问都可以跟我们沟通,我们可以利用我们的资源尽力帮助老师解决问题。
3. 如果客户想采取 invitrogen 体系或者购买 clontech 的文库,那么客户就需要购买相应的 BD 构建及筛库试剂盒,这个价格并不便宜,而如果采用我们公司提供的技术服务,我们可以免费提供给客户 BD 载体以及筛库所需要的菌株,这样客户只需要购买相应的培养基就可以开展后续实验。
九.重要提醒
1. 客户拿到所有产品收到产品后及时观察运输干冰情况,所有产品一律-80℃保存,所有菌液不能反复冻融。
2. 客户拿到文库需尽快涂布相应平板进行验证。
十.常见问题及解决方案
1. 如果诱饵蛋白存在自激活,该如何处理?
该蛋白很可能带有完整的AD区和BD区,是个完整的转录因子,可以将转录因子基因分成两部分分别进行文库筛选,然后重新检测其是否自激活,但要注意切割也有可能破坏蛋白之间的相互作用。
2. 转化效率太低怎么办?
1) 检测感受态细胞效率,标准操作规范。
2) 注意质粒使用量,检查仪器状态。
3) 重新配制新鲜培养基,并做对照转化。
3. 如果诱饵蛋白对酵母细胞是有毒的,该怎么办?
在某些情况下,在液体培养基中培养不好的菌珠可以在固体培养基上生长得很好。首先重悬克隆于 1ml 的 SD/–Trp,接着将重悬液平铺于 5 个 100-mm 的 SD/–Trp 平板,在 30℃下温浴,直至平板上的克隆相互粘在一起。用 5ml 0.5X YPDA 刮下每块板上的克隆,并收集到一管中,这样就可以使用这个细胞重悬液进行正常的杂交反应。
4. 杂交效率不高,该如何处理?
在杂交中,预转化的诱饵细胞的数量可能不够。当对诱饵菌株进行液体培养过夜时,应挑选大的、新鲜的克隆进行培养,经过离心和重悬后,再使用血球计对细胞进行计数。密度应该在 1 x 109/ml。
一个甚至两个融合蛋白对酵母细胞有毒。你可以通过重组方法来减轻毒性,同时又能保证蛋白的相互作用。或者使用表达水平较低的载体。也可以在琼脂平板或滤膜上进行杂交。但同时必须作杂交对照实验。